46 th International Chemistry Olympiad Hanoi, Vietnam 14 Preparatory Problems 三種のイオンFe 3, Al3, Mg 2 を001 M から01 M の濃度範囲内に含む一つのサンプル溶 液を調製しなさい。 ステップ 2鉄鉄鉄鉄、、、、アルミニウムアルミニウム、、、マグネシウムイオン、マグネシウムイオンのののの滴定滴定キレート滴定ではpH により試料と滴定試薬との反応性が変化するため、pH ・コバルト、ニッケル、銅、亜鉛、カドミウム、水銀 : 80g/Lシアン化ナトリウム溶液2mLを 上記の計算式で、カルシウム、マグネシウムの合量およびカルシウム濃度を算出し滴定液名 01mol/L EDTA 電極名 自動入力先パラメータ 無し 滴定条件例 滴定曲線例 測定結果 測定回数 試料量(mL) 滴定値(mL) 濃度(g/L) 1 5 7623 9639 2 7603 9614 3 7622 9638 4 7611 9624 5 7595 9603 平均値 : 962g/L 統計計算 標準偏差 : 002g/L
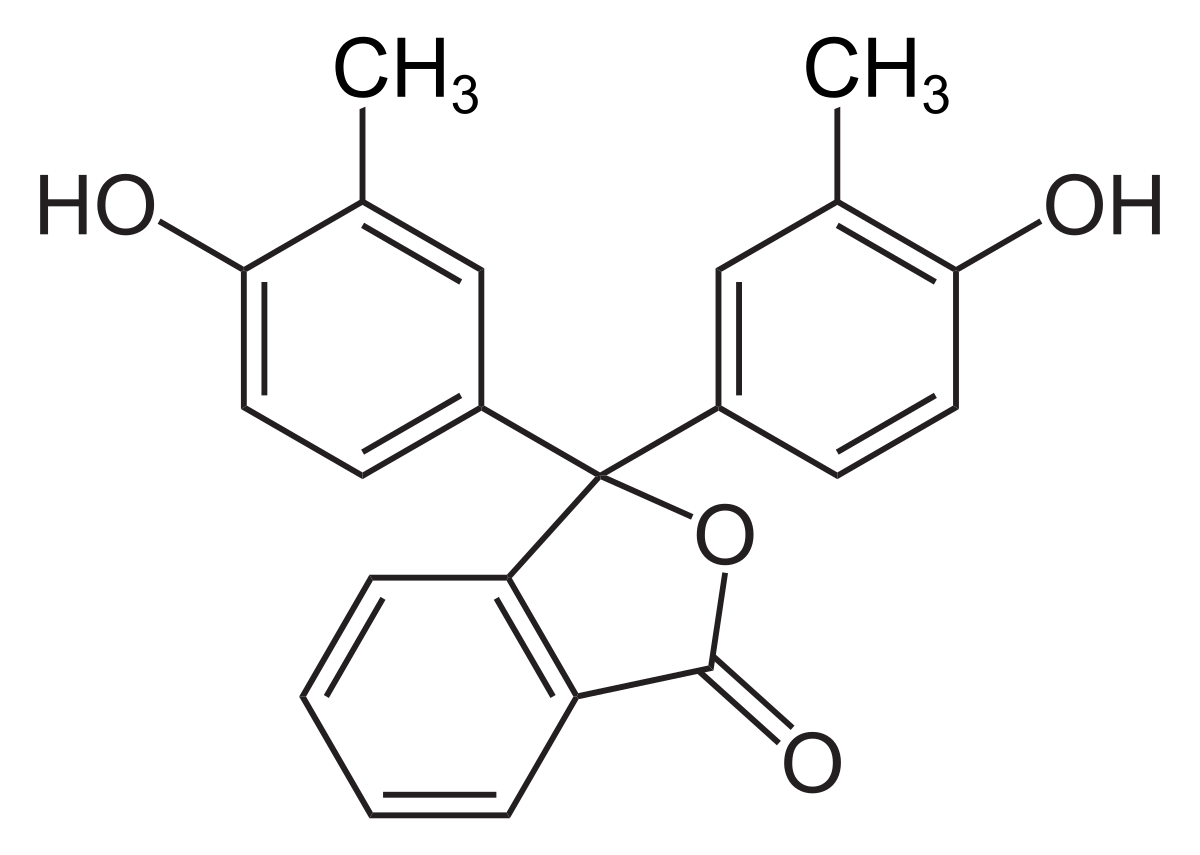
クレゾールフタレイン Wikipedia
キレート滴定 計算 亜鉛
キレート滴定 計算 亜鉛-問題28 キレート滴定法による銅と亜鉛の定量 合金は、日々の生活の様々な場面で使用されている。とりわけ、その特性(たとえ ば伝導性,機械的特性あるいは耐食性など)により、合金は航空学,建水の硬度測定(キレート滴定 edata標準溶液の滴定所要量から計算によって検水の全硬度およびカルシウム硬度を決定する。 (6) edta2na試薬は特級を使用するが、さらに正確を期するときは純粋な亜鉛や銅などの金属標準溶液で評定する。




1997 号 金属イオンのための酵素増幅競合アッセイ及びサンドイッチキレート化アッセイ Astamuse
· キレート滴定 要旨 まず亜鉛の固体を精秤しこれを酸で溶かす。この亜鉛溶液でedtaを標定し、そのedtaで塩化銅(ii)を標定する。 目的 金属イオンを容量滴定によって標定する方法としては、エチレンジアミン四酢酸(edat)によるキレート滴定が最も一般的である。が,ph6に おいて亜鉛,カ ドミウムのうち,カ ドミウ ムのみと安定なキレートを生成して,edtaに よるキ レート滴定からいんぺいすることが知られているす な わち鉛と同量以下のカドミウムは,ジ メルカプキレート滴定の手法は、「銅及び銅合金中のニッケル定量方法」jis h 1056 を参照し、一定量の edta を加えてニッケルの edta 錯体を生成させた後、過剰の edta を亜鉛の溶液で滴定するという、逆滴定を採用しました。
4.キレート滴定 41 001MEDTA 標準溶液の調製 要点 4. 001M亜鉛標準溶液で滴定し、青色が紫色に変わる点を終点とする。 5.滴定結果より、試料溶液 250ml 中に存在する Ni の重量を計算する。 4 4 置換滴定法 定量しようとする金属ムおよび亜鉛ではEDTA錯塩の方がシアノ錯塩よりも 金属イオン濃度が小さく(弟1,2表参照)例えばZn (CN)4 の場合〔CNlが6×10~3モルでNa2ZnY錯 垢と平衡になる。(01モルの場合)。後 の滴定操作に従 う場合,銀,銅および亜鉛またほカドミウムの全部をシ目次 キレート滴定の手法 キレート滴定にもちいられる試薬 キレート滴定法における選択性 キレート滴定に常用される試薬類 金属イオンの滴定法 陰イオンおよび有機化合物の分析への応用 「BOOKデータベース」 より
金属イオンの滴定法をキレート滴定法と呼ぶのもそのた めです 3 滴定試薬としての応用(キ レート滴定法) 3・1 キレート滴定法の原理 ふたたび反応式(iii)に ついて考えてみましょう あ る金属イオン(m)の 水溶液にedta溶 液(y)を 滴日本大百科全書(ニッポニカ) キレート滴定の用語解説 金属イオンが多座配位子で囲まれて安定な錯化合物を生成するとき、その化合物をキレートというが、多くの金属イオンと安定なキレートを生成するedta(エチレンジアミン四酢酸)およびその類縁化合物のアミノポリカルボン酸類を滴定ビュレットの0.01M-EDTA標準溶液で滴定を行う。 溶液の色が赤紫色から青色になったところを終点とする。 6) 1~5を3回繰り返し、滴定平均値を求める。 7) Ca硬度を計算し求める。 8) Mg硬度を計算し求める。
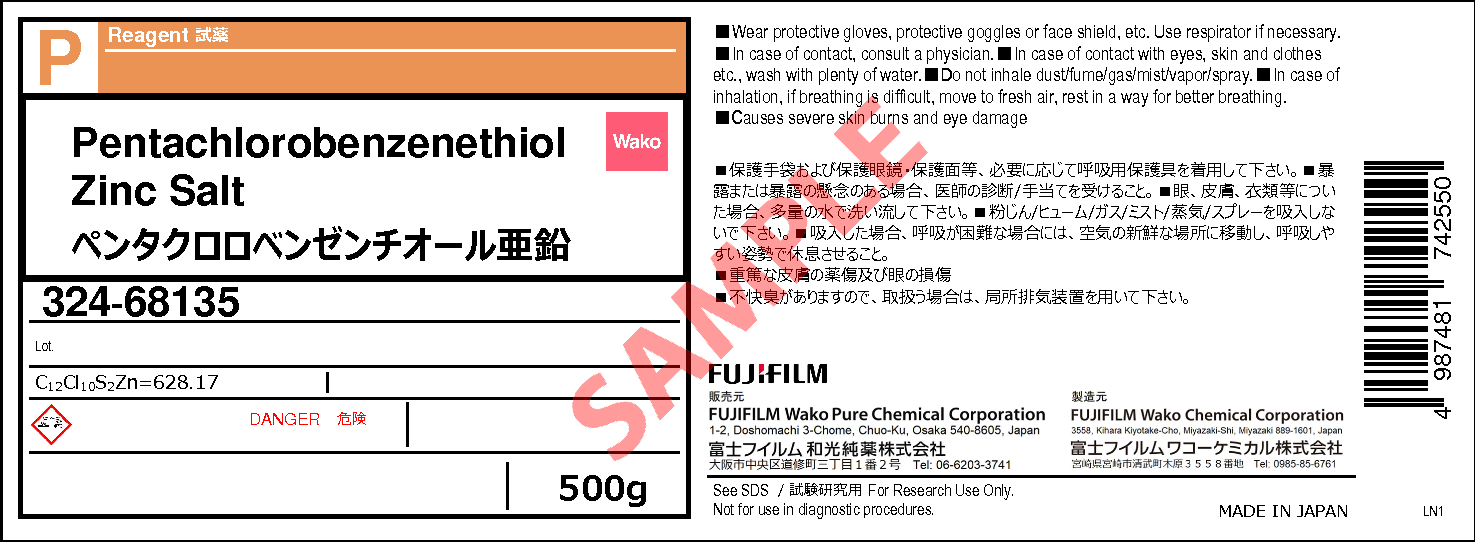



117 97 5 ペンタクロロベンゼンチオール亜鉛 Pentachlorobenzenethiol Zinc Salt 3 324 詳細情報 試薬 富士フイルム和光純薬




サルヴァトーレ フェラガモ Salvatore Ferragamo レディース ローファー オックスフォード Brogues Nero靴 ブローグ フェラガモ Salvatore シューズ 靴 Cosette Leather Brogues Nero フェルマートサルヴァトーレ フェラガモ レディース シューズ 靴 ローファー
Edta滴定によるアルミニウムの定量について1 マンガンの共存における アルミニウムの逆滴定法 一土壌分析への応用一 新名謹之助的 1序言 土壌・土壌粘土または土壌抽出液中のアルミニウムの直接的*定量法としては,筆者はすでに前報5)6)キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。滴定用キレート試薬として、ドータイト2na(edta2ナトリウム 塩)、その他ドータイト金属指示薬、キレート滴定用補助試薬など、 キレート滴定に必要な試薬類は全部とりそろえているので、ご利 用いただきたい。 nc h2ch2 n ch 2cooh hoocch2 ch2cooh hooc 2 on o n m ch2 ch2




滴定の解説 イプロスモノシリ モノシリ 製造業技術用語集




キレート滴定に用いられる主な標準液 指示薬のゴロ 覚え方 ごろごろ覚える薬学生ゴロ 薬剤師国家試験対策
キレート滴定における終点の検出 金属指示薬:金属イオンの濃度変化により鋭敏に変色 (指示薬も金属イオンとキレートを形成する) エリオクロムブラックt (ebt) n n oh oh so 3 h no 2 h3in 2 ph 変化に伴うebt 指示薬の色調変化 n n oh oh so 3 h no 2 h3in pka1=16 pka2=63Q18 キレート滴定法で行う硬度分析. q17 電解水をよう素滴定法で分析する原理. q10 塩化亜鉛水溶液に塩酸を少量加え,亜鉛板と銅板を接触させて入れて高温を保つと,銅に亜鉛が析出する理由.質問箱 名前: 芦田 実 日時:02年09月22日 14時50分 岸本 博文 様 必ずしも専門家ではありませんので,不正確な回答もあります.教育学部から公開しているホームページの質問箱とQ&A集にも回答(一部)を載せたいと思います. 質問18 キレート滴定法
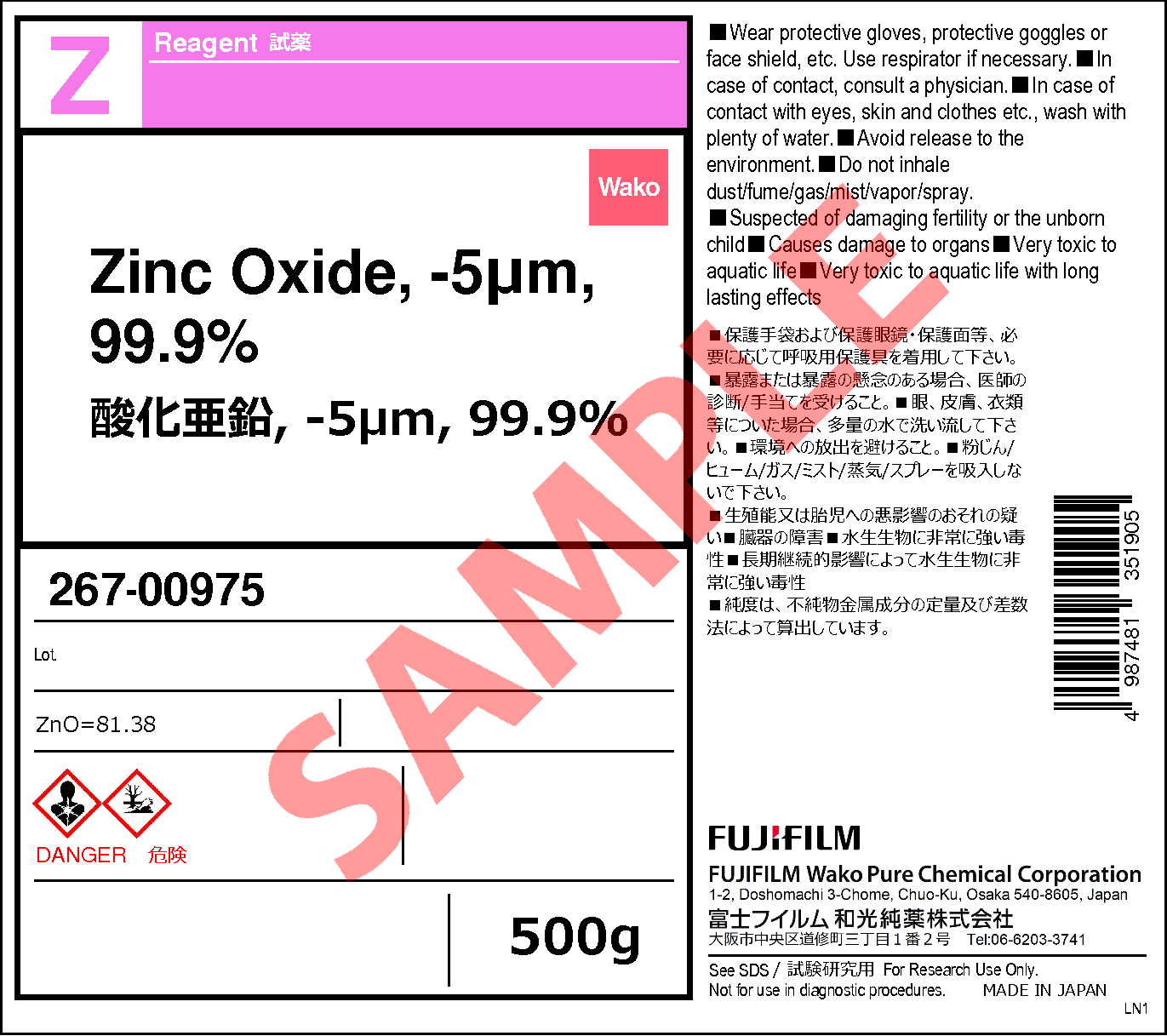



1314 13 2 酸化亜鉛 5mm 99 9 Zinc Oxide 5um 99 9 265 267 詳細情報 合成 材料 試薬 富士フイルム和光純薬
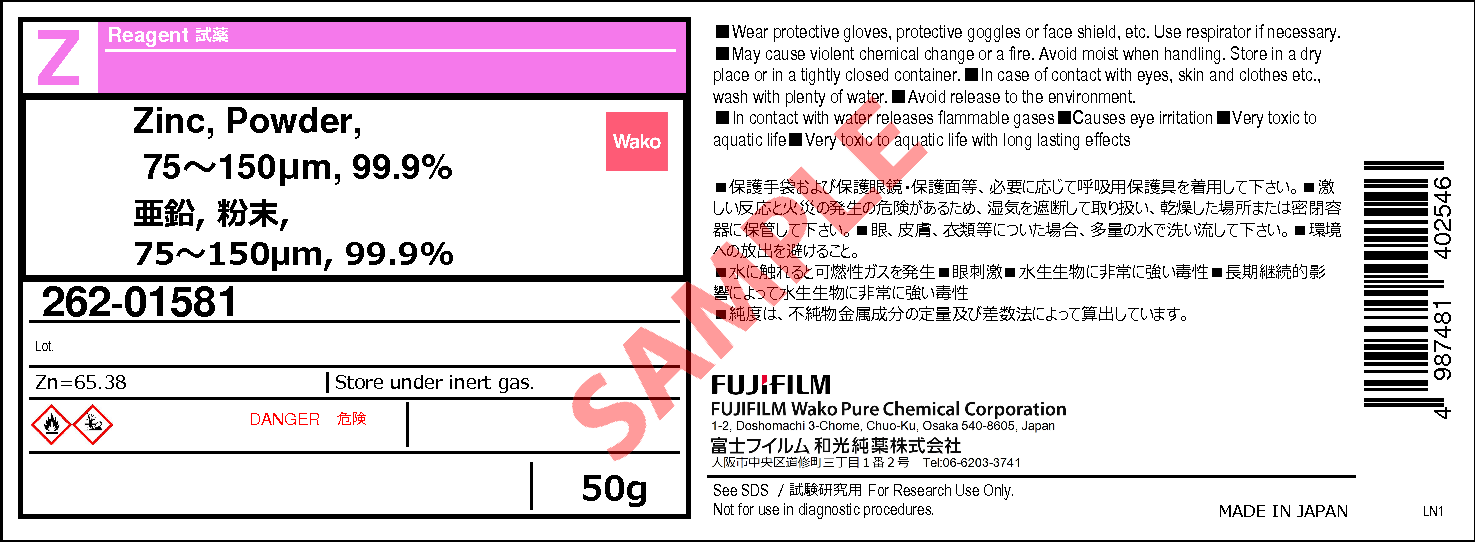



7440 66 6 亜鉛 粉末 75 150mm 99 9 Zinc Powder 75 150um 99 9 262 詳細情報 合成 材料 試薬 富士フイルム和光純薬
3.edtaによるキレート滴定 競技では,edtaによるキレート滴定の原理やebt指示薬やnn指示薬を用いてca2+ やmg2+ を定量する具体的な方法を問題文の1,2ページに記載し,初学者にも充分理解で きるように配慮した。次に実験操作の手順を簡潔に示す。水の硬度とは、水に溶けているCa 2+ およびMg 2+ の量をCaCO 3 (ppm)に換算したものである。 硬度には、全硬度(Ca 2+ とMg 2+ )、Ca硬度、およびMg硬度がある。 EDTA(エチレンジアミン四酢酸)は、最大6本の腕(6座配位)で2価~4価の金属イオンと、そのイオンの価数に関係なく1:1で結合します。水道水のカルシウム硬度測定はキレート滴定 (銅、鉄、亜鉛のマスキング) 試薬の取扱に注意! ④ 10W/V%-塩酸ヒドロキシルアミン溶液5滴を加えます。 計算 式




Edta 滴定曲線 溶解度などーエクセルを用いて




Vol 65 9 研究論文 亜鉛微粒子の接触を利用する無電解スズめっき 内田 衛 A 田中 薫 A 川端 愛 A 鍋島祥太 B 鶴岡孝章 B 赤松謙祐 B 縄舟秀美 B B A 石原ケミカル 兵庫県神戸市兵庫区西柳原町 5 26 甲南大 Pdf
京都大学 全学共通教育 基礎化学実験ホームページ:http//wwwchemzenkyohkyotouacjp/化学実験操作法:操作法 2 4 キレート · 亜鉛02gはおおよそ0003mol、これを500mLで薄めるので0006mol/Lと濃度を計算します。 滴定するとき、15 mLとるので90 mmol (ミリモル)入っています。 EDTAと亜鉛は当量点までは残さず反応するので、滴下したEDTAのモルは90 mmolです。キレート滴定 多座配位子EDTA(標準液)が 金属イオン(Zn 2, Mg 2, Ca , Al3, Cu 等)と 水溶液中で安定な可溶性のキレート化合物を生成する ことを利用した滴定法 →容量分析による金属イオンの定量法 *滴定終点判定法は次週に解説する 9 キレート滴定の




17 号 可搬型滴定装置 Astamuse



7440 66 6 亜鉛 Zinc 261 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬
4. 001M亜鉛標準溶液で滴定し、青色が紫色に変わる点を終点とする。 5.滴定結果より、試料溶液250ml中に存在するNiの重量を計算する。 4 4 置換滴定法 定量しようとする金属イオン M12の溶液に M 2Y 2-溶液を加えると、次の平衡が成り立 つ。 M1 2 + M 2Yキレート滴定法は,金属キレート錯体の生成反応を利用して,金属イオン を定量する方法である。たとえば,水道水など飲料水中に含まれるマグネシ ウムおよびカルシウムイオン濃度,すなわち,水の硬度はedta を用いる キレート滴定によって簡単に測定亜鉛イオン(Zn2)は、キレート滴定によって容易に定量できます。亜鉛のEDTA による滴定が できるpH 領域(pH45~10)は広くかつEDTA に対する安定度定数も大きく、鋭敏に変色する 指示薬も多




17 号 可搬型滴定装置 Astamuse




Jpb2 Cross Linked Complex Containing Lubricant Google Patents
となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤 一般にキレート滴定はかなり高い pH で行なうが、このとき金属水酸化物を沈殿させな いように、 EDTA より Kf の小さい錯化剤(=補助錯化剤 )を共存させることが33.キレート滴定 キレート滴定では、金属イオンとキレート試薬(もっぱらedtaが使われる)が安定な錯体を作ることを利用する。 したがって、たとえば ebt の場合は滴定の終点として、完全に赤みの消えたところを取る。 キレート滴定では、ph の設定にI キレート滴定による亜鉛イオン濃度の決定 1 キレート滴定におけるチオ硫酸ナトリウムの役割を説明せよ。 2 滴定の結果に基づき試料中の亜鉛イオンの濃度を求めよ。 ii ヨウ素還元滴定による銅イオン濃度の決定 1 滴定過程の化学反応式を書け。 2




薬液処理浴自動管理装置 めっき管理主任シリーズ のご紹介 Ppt Download




公開公報 その他のものに関する技術公報一覧 Astamuse
水道水の総硬度測定はキレート滴定 (銅、鉄、亜鉛のマスキング) 取扱注意! ⑥ EBT指示薬溶液0.5mlを加え、0.01mol/L-EDTA溶液で滴定します。(赤→青) 計算滴定の結果、EDTA 15.42mlを要し、0.01Mとした計算値 10.00/0.6537=15.30ml と比較して、0.01M EDTA = 0.M と標定された。 · キレート滴定(キレートてきてい)とは。意味や解説、類語。金属イオンなどの試料物質が、適当な配位子と反応してキレート化合物を作ることを利用した滴定法。 goo国語辞書は30万4千件語以上を収録。政治・経済・医学・ITなど、最新用語の追加も定期的に行っています。




Edta キレート エチレンジアミン四酢酸 Edta




1997 号 金属イオンのための酵素増幅競合アッセイ及びサンドイッチキレート化アッセイ Astamuse




Rec Realeducationcompany 大阪市 Education Medical Company Facebook




7440 66 6 0 1mol L 亜鉛溶液 0 1mol L Zinc Solution 261 詳細情報 分析 試薬 富士フイルム和光純薬




Jpa 硫酸アルミニウムの製造方法 Google Patents



細胞内の亜鉛の新しい生理的役割が明らかに 亜鉛とシャペロンタンパク質erp44による新しいタンパク質品質管理機構の仕組みを解明 プレスリリース Spring 8 Web Site




キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ




キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ



油分分析の基礎 株式会社ユニケミー ユニラボ




ミネラル サプリ キレート 滴定
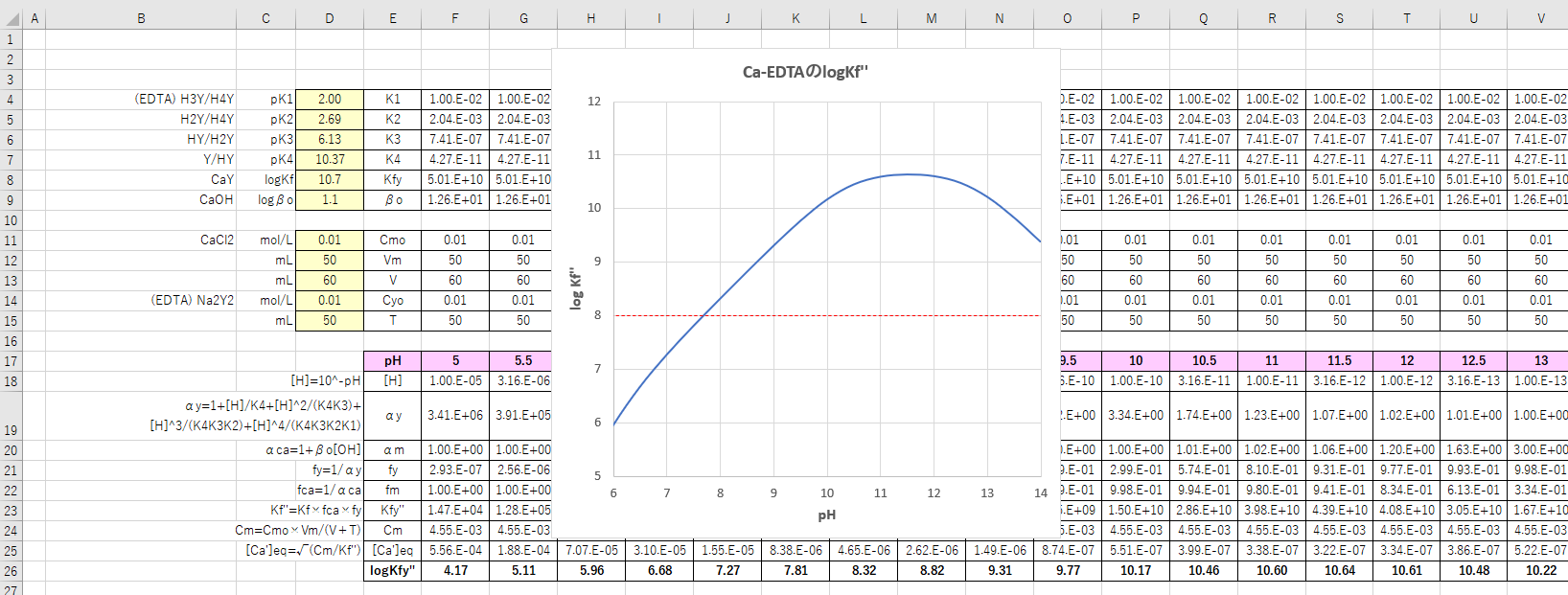



年06月 滴定曲線 溶解度などーエクセルを用いて




17 号 可搬型滴定装置 Astamuse




19 号 カルシウム溶解促進剤 Astamuse



水の硬度 株式会社ユニケミー ユニラボ




7446 0 硫酸亜鉛七水和物 Zinc Sulfate Heptahydrate 264 268 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬




Woa1 タイヤ用ゴム組成物 及び空気入りタイヤ Google Patents



薬液処理浴自動管理装置 めっき管理主任シリーズ のご紹介 Ppt Download



7646 85 7 塩化亜鉛 99 9 Zinc Chloride 99 9 260 268 262 詳細情報 合成 材料 試薬 富士フイルム和光純薬




Woa1 結晶性l カルノシン亜鉛錯体を含有する精製体の製造方法 Google Patents




602 表面技術 技術論文 めっき亜鉛の結晶構造と表面形態に及ぼす光沢剤の影響 津留豊 A 小林佳弘 B 伊東真吾 B 大和秀一郎 B 矢野正明 C A C 九州工業大学シニアアカデミー 福岡県北九州市戸畑区仙水町 1 1 B 九州工業大学工学部 Pdf Free Download




1314 13 2 酸化亜鉛 Zinc Oxide 263 267 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬




07 号 二核化配位子及びその二核亜鉛錯体 Astamuse
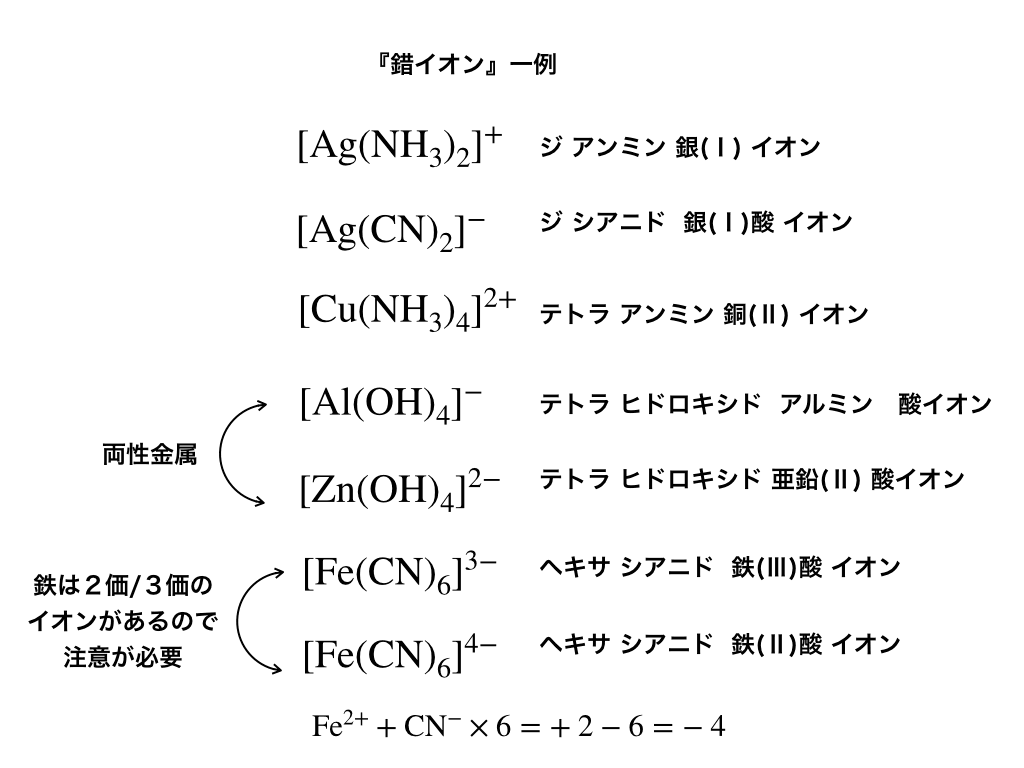



錯イオンとは 命名法や構造 配位子などの意味 覚え方まで詳しく解説




クレゾールフタレイン Wikipedia




塩基性炭酸亜鉛 Zinc Carbonate Basic 266 詳細情報 試薬 富士フイルム和光純薬




Edta キレート エチレンジアミン四酢酸 Edta



乳酸亜鉛三水和物 Zinc Lactate Trihydrate 266 詳細情報 試薬 富士フイルム和光純薬




7646 85 7 塩化亜鉛 99 9 Zinc Chloride 99 9 260 268 262 詳細情報 合成 材料 試薬 富士フイルム和光純薬




キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ
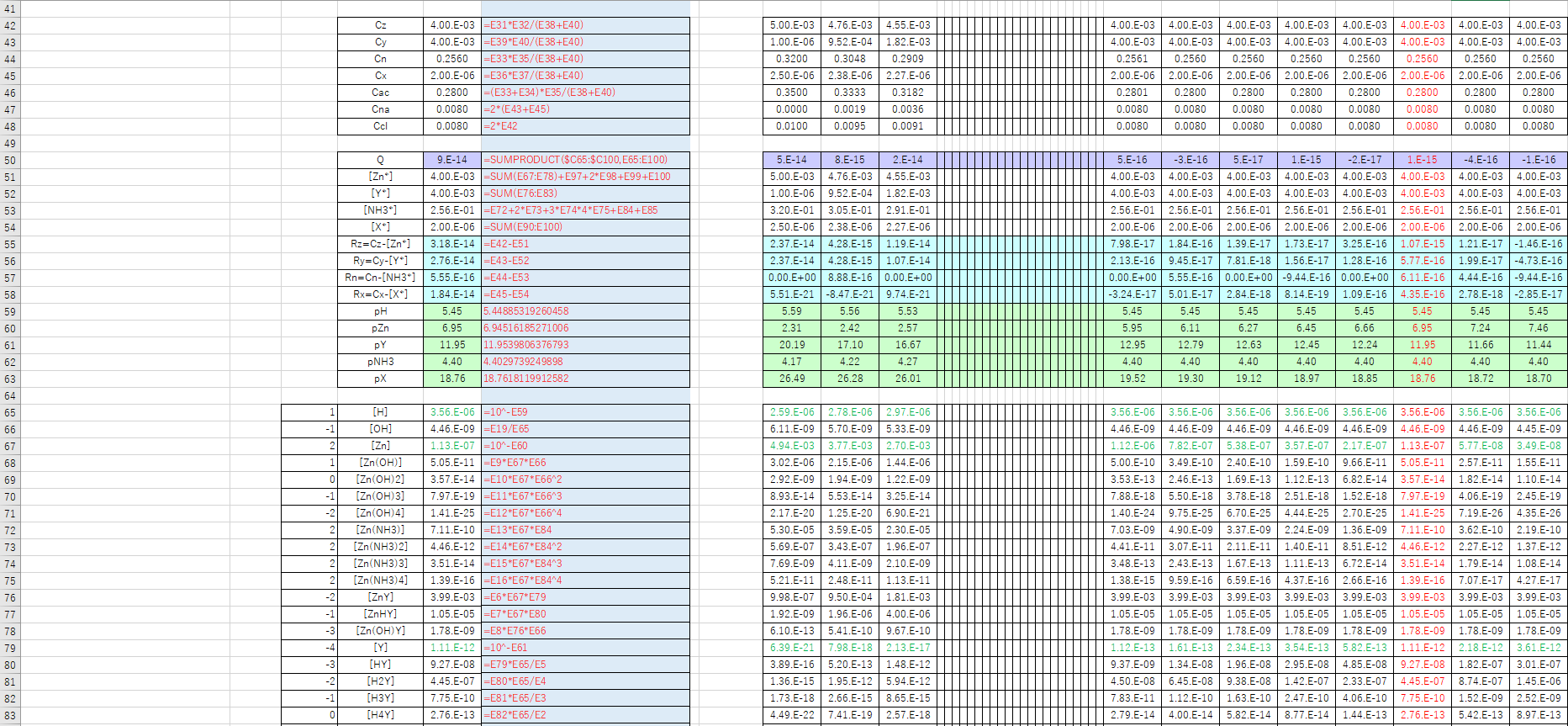



亜鉛のedta滴定 2 滴定曲線 溶解度などーエクセルを用いて




557 34 6 0 01mol L 酢酸亜鉛溶液 0 01mol L Zinc Acetate Solution 260 詳細情報 分析 試薬 富士フイルム和光純薬




Woa1 結晶性l カルノシン亜鉛錯体を含有する精製体の製造方法 Google Patents




5970 45 6 酢酸亜鉛二水和物 Zinc Acetate Dihydrate 263 267 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬




17 号 可搬型滴定装置 Astamuse



3回生実験のこと 合金の分析




キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ




4980 54 5 P T ブチル安息香酸亜鉛 Zinc P T Butylbenzoate 260 262 詳細情報 試薬 富士フイルム和光純薬



155 04 4 2 メルカプトベンゾチアゾール亜鉛 2 Mercaptobenzothiazole Zinc Salt 328 322 詳細情報 試薬 富士フイルム和光純薬




黒田真生 Naoki Kuroda Su Twitter 正答 1 2 3 エリオクロムブラックt 塩化ナトリウム指示薬である 4 亜鉛 とedtaがキレートを作ることによる 5 亜鉛とedtaは1 1で結合するから 0 05 81 38 40 69となる



7646 85 7 塩化亜鉛 99 9 Zinc Chloride 99 9 260 268 262 詳細情報 合成 材料 試薬 富士フイルム和光純薬




1997 号 金属イオンのための酵素増幅競合アッセイ及びサンドイッチキレート化アッセイ Astamuse
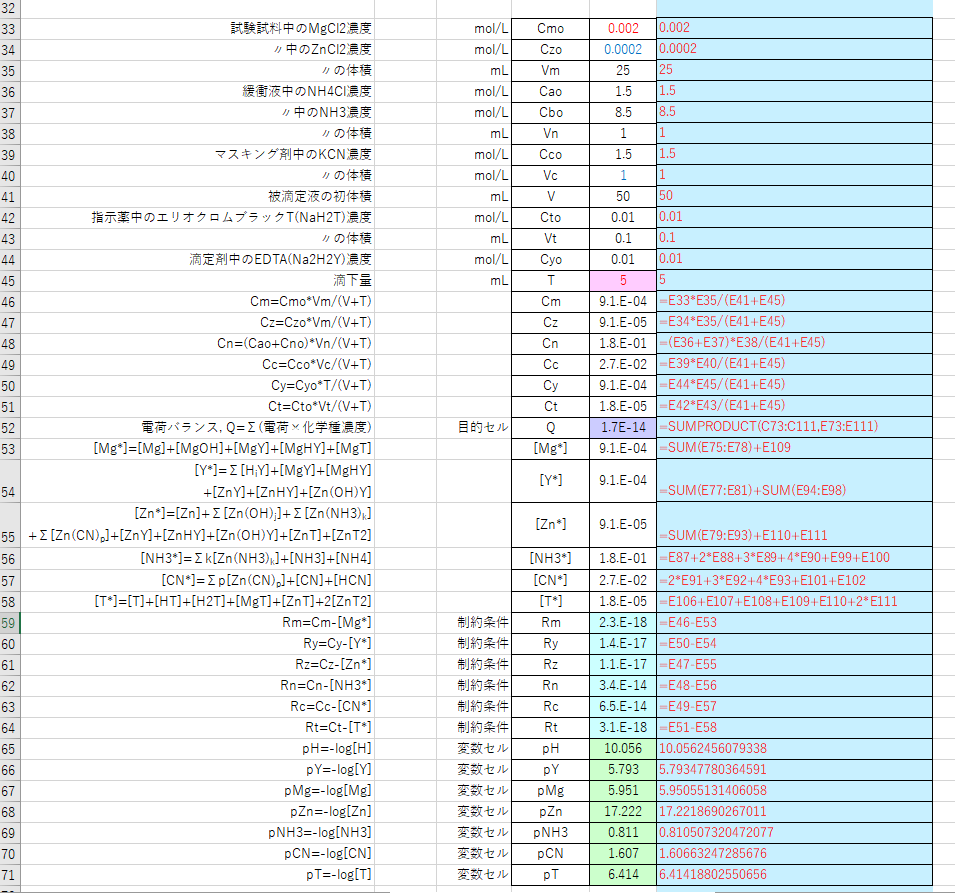



Edta 滴定曲線 溶解度などーエクセルを用いて




Woa1 手袋及び手袋用組成物 Google Patents




557 34 6 0 1mol L 酢酸亜鉛溶液 0 1mol L Zinc Acetate Solution 267 詳細情報 分析 試薬 富士フイルム和光純薬




07 号 二核化配位子及びその二核亜鉛錯体 Astamuse



3回生実験のこと 合金の分析




Edta 滴定曲線 溶解度などーエクセルを用いて




602 表面技術 技術論文 めっき亜鉛の結晶構造と表面形態に及ぼす光沢剤の影響 津留豊 A 小林佳弘 B 伊東真吾 B 大和秀一郎 B 矢野正明 C A C 九州工業大学シニアアカデミー 福岡県北九州市戸畑区仙水町 1 1 B 九州工業大学工学部 Pdf Free Download



0 件のコメント:
コメントを投稿